类风湿关节炎(RA)-被称为“不朽的癌症”!
类风湿关节炎(ra)是一种以关节持续性滑膜炎和全身炎症为特征的慢性自身免疫性炎症性关节病。其主要病理机制是多种免疫细胞的异常激活,导致慢性炎症的持续存在。炎症刺激成纤维细胞样滑膜细胞(fls),fls具有侵袭性,可导致关节损伤和破骨细胞活性增强,介导过度骨吸收[1,2]。
在美国,超过5000万成年人和30万儿童患有某种形式的关节炎。这在妇女中最为常见,而且随着年龄的增长而更为频繁。
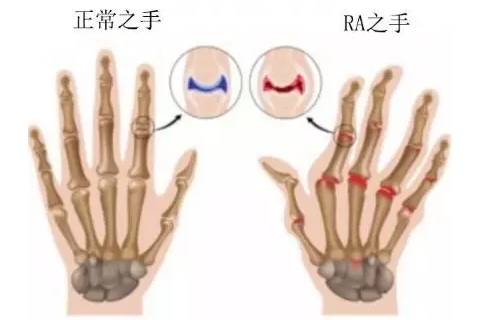
关节炎的常见症状包括肿胀、疼痛、僵硬和活动范围缩小,这些症状可能会在几年内保持不变,但会随着时间的推移而增加。严重的类风湿关节炎会导致无法进行日常活动,使步行或爬楼梯变得困难。类风湿关节炎除了破坏小关节外,还可以侵犯皮肤、眼睛、肺、心脏、肾脏、唾液腺、神经组织、骨髓和血管。
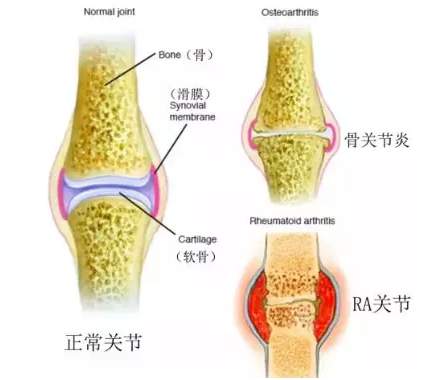
类风湿关节炎不同于骨关节炎,类风湿关节炎属于自身免疫性疾病,常破坏四肢小关节;而骨关节炎属于慢性炎症,但不属于自身免疫性疾病,病变主要为大关节。
目前,ra的治疗主要依靠非甾体抗炎药(nsaid)、糖皮质激素和改良抗风湿药(dmards),这些药物能明显改善患者的症状,但长期使用会导致严重的不良反应,包括感染,骨髓抑制,肝肾功能不全。尽管一些生物制剂取得了良好的效果,但约30%的患者在试验中对治疗反应不满意。即使在临床病情缓解后,软骨和骨损伤仍在继续发展。
因此,一个具有挑战性的目标是通过永久免疫耐受诱导炎症缓解,防止关节结构持续恶化,修复现有损伤。
造血干细胞治疗
由于免疫细胞来源于造血干细胞,是造血干细胞的后代,推测类风湿关节炎可能存在造血干细胞功能缺陷,导致后代免疫细胞异常持续活化,不能承认友军和敌军。
ra患者骨髓cd34细胞数量少,具有克隆缺陷的潜能。此外,体内肿瘤坏死因子α(TNFα)可加重骨髓干细胞的损伤[3]。循环造血干/祖细胞(hspc)也减少。约10-15%的hspc表现为增殖障碍和定向细胞分化障碍,伴有端粒长度缩短[4,5]。
15个临床中心76例难治性类风湿关节炎患者的临床研究表明,自体造血干细胞移植(asct)治疗难治性类风湿关节炎具有良好的耐受性,短期内有较好的疗效;大多数患者有显著的反应,超过50%的患者在12个月内达到美国风湿病学会50%的改善(acr50;健康评估问卷(haq)在18个月内显著下降;rf阴性患者对hsct的反应优于rf阳性患者。然而,大多数患者在6个月后出现癫痫发作。即使自体造血干细胞被纯化后移植,在大多数ra患者中也面临复发的问题[7]。
这说明自体造血干细胞在ra患者的治疗中长期疗效不佳,可能存在一些局部因素影响造血干细胞向免疫细胞的正常分化。因此,健康异基因造血干细胞移植可用于难治性ra的治疗[8]。
间充质干细胞治疗
mscs具有强大的免疫调节功能,可以通过一系列机制调节炎症反应,包括适应性免疫反应和先天性免疫反应。包括抑制t细胞增殖和功能,抑制b细胞,抑制树突状细胞成熟,促进巨噬细胞向抗炎表型分化,抑制nk细胞,诱导cd4-cd25-foxp3调节性t细胞(tregs)[9,10]。
动物实验研究表明,骨髓间充质干细胞治疗RA的机制包括:(1)降低血清中炎性细胞因子和趋化因子的浓度;(2)减少转移淋巴结和关节中抗原特异性Th1/Th17和Th1/Th2反应的增殖;(3)诱导抗原特异性CD4 CD25 Foxp3 T细胞(Treg细胞)或Tr1(IL-10CD)。(4)抑制成纤维细胞样滑膜细胞和破骨细胞的活化。
在类风湿关节炎患者中,mscs可以抑制免疫反应,促进调节性t细胞的增殖[11]。成纤维细胞样滑膜细胞(flss)和破骨细胞的激活也参与ra的发病过程。mscs还能抑制flss的增殖、侵袭和炎症因子的分泌[12,13]。mscs对nf-kappa b配体受体激活剂诱导的破骨细胞分化具有较强的抑制作用[14]。mscs还能抑制ra患者巨噬细胞的极化,使巨噬细胞由炎症型向抗炎型转变,从而改善局部炎症微环境[15]。
但ra患者骨髓间充质干细胞的增殖、迁移、免疫抑制及内皮祖细胞因子表达均下降[16,17]。ra患者骨髓间充质干细胞增殖潜能降低与端粒长度过早丢失有关[16]。ra患者骨髓mscs中ccl2蛋白的低表达导致mscs免疫抑制功能受损[17]。因此,同种异体健康mscs成为ra治疗的必然选择。
4例对dmards耐药的ra患者和至少1种抗肿瘤坏死因子α药物静脉注射健康异基因骨髓间充质干细胞是安全的。移植后1个月和6个月,四分之三的患者血沉、das和vas评分下降。两名患者分别在7个月和23个月时病情有所改善。复发发生在月底,2名患者无反应[18]。2018年在中国进行的一项临床研究显示,mscs治疗的活动性ra患者的γ干扰素浓度相对较高(>2pg/ml),而mscs无反应的患者的γ干扰素浓度非常低。治疗效果与干扰素γ浓度呈正相关[19]。
除给予dmards外,136例活动性ra患者静脉注射uc-mscs(每人4000万mscs,1-2次),与对照组(dmards治疗组)36例相比有显著改善。疗效持续3~6个月,与外周血tregs比值升高有关[11]。本研究发现,外周血treg细胞的数量可以作为疗效的客观指标之一。当treg细胞数恢复正常或接近正常时,ra症状明显减轻。
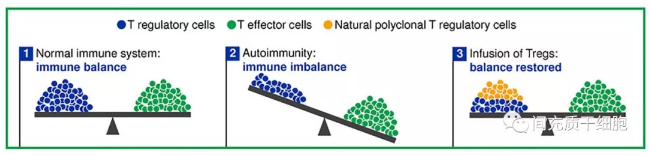
treg细胞在免疫系统中非常重要。它们能维持免疫平衡,诱导免疫耐受。如果treg细胞数量减少,效应t细胞的侵袭性不能受到限制,导致免疫平衡不能维持,就会发生自身免疫性疾病。如果补充或增殖treg细胞以恢复免疫平衡,就不会发生自身免疫性疾病(见图)。
在多中心、剂量递增、随机、单盲(双盲)安慰剂对照IB/IIA期临床试验中,46例活动性难治性类风湿关节炎(至少两种生物制品无效)患者在3个月内静脉注射同种异体脂肪间充质干细胞(cx611),总体耐受性良好,无毒性迹象,但3个月后未出现这种趋势。持续性,提示ra的细胞治疗需要反复给药[20]。另外,9例患者检测到抗脂肪间充质干细胞hla-i抗体,但未发现抗hla-ii抗体。在本次临床研究中,最常见的不良反应为发热(9例,17%)、呼吸道感染(8例,15%)、头痛(6例,11%)、尿路感染(6例,11%)、恶心(5例,9%)、关节痛(3例,6%)、疲劳(3例,6%)和呕吐(3例,6%)。
2018年韩国报道脐血来源的MSCs治疗9名RA患者的Ia期临床试验,单次静脉注射2千5百万、5千万、1亿三个剂量,治疗4周后,9名RA患者的DAS28-ESR评分从4.53±1.35降到2.93±1.22、疼痛VAS评分从64.8±20.2降到46.9±29.1;而且最高MSCs剂量组的炎症因子下降最明显[21]。
将荧光素酶注入蛋白多糖诱导的关节炎小鼠关节,转染mscs。根据生物发光成像,mscs在关节内停留4-5周,但在关节腔外没有检测到mscs[22]。这表明mscs可以被关节腔内的关节组织清除,这也说明需要反复注射才能维持疗效。
总之,间充质干细胞(mscs)治疗类风湿关节炎(ra)的机制有两点[23]:
免疫调节,抑制免疫反应,消除炎症,促进treg细胞恢复正常水平,从而维持免疫平衡;
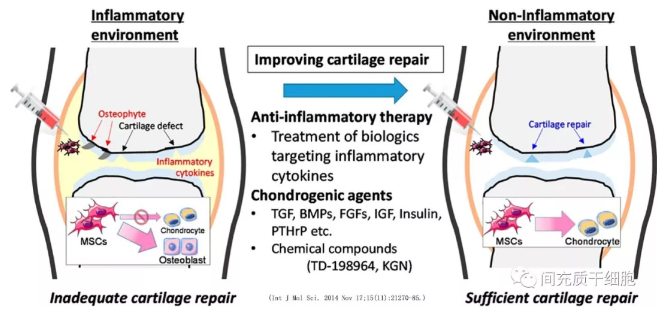
(2)在免疫调节的基础上,促进软骨细胞和成骨细胞的增殖,抑制破骨细胞的活性,促进软骨再生和受损骨组织的修复(见图)。
结论:健康异基因造血干细胞(hscs)和间充质干细胞(mscs)是治疗难治性ra较为安全有效的方法。
mscs具有较强的免疫调节能力和较低的免疫原性,更适合于难治性ra的治疗。然而,仍有少数人不能取得良好的疗效,可能是由于患者所处的环境限制了mscs的功能;大部分ra患者在一段时间后会复发,可能是由于进口mscs不能长期存活,需要反复和反复使用。长期使用mscs。
破坏和变形的关节不能通过干细胞恢复到原来的健康状态,但干细胞被认为可以改善疼痛和阻止恶化。


