胰腺是胃后面和小肠旁边的一个长而平的腺体,约14-20厘米长,位于上腹部的胃后面。
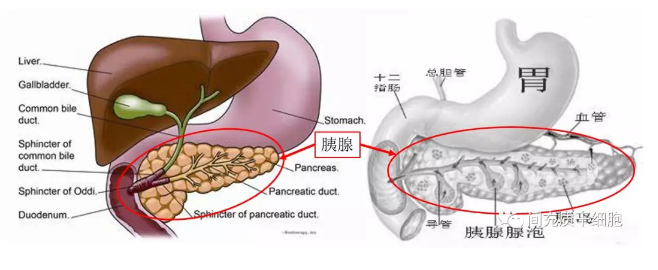
胰腺主要做两件事:①它释放出强大的消化酶进入小肠,以帮助消化食物;②它将胰岛素和胰高血糖素释放到血液中,帮助身体控制如何利用食物来获取能量。
急性胰腺炎和慢性胰腺炎的原因相似,欧洲约80%-90%是由酗酒和胆结石引起的(各约35%-45%);其余10%-20%是由药物、化学物质暴露、创伤、遗传性疾病、感染、外科手术和血液中的高脂肪水平以及胰腺或肠道的遗传异常引起的[1]。
胰腺释放消化酶的量跟胃里面的食物密切正相关,食入量越多,分泌的消化酶就越多。因此,暴饮暴食能短时间增加胰腺分泌消化酶,消化酶反过来对胰腺组织进行消化破坏,引起急性胰腺炎。胆道的结石如果进入胰腺管,消化液被困住,开始“消化”胰腺本身,造成胰腺炎,这种胰腺炎可能是急性的(新的,短期的),也可能是慢性的(持续的,长期的)。任何一种类型都可能非常严重,有严重的并发症,甚至危及生命。
急性胰腺炎的症状通常始于腹部中或左上方的腹痛,吃东西或平躺背部后腹痛可能会加重。重症急性胰腺炎的症状和体征可能表现为肚脐周围或身体两侧肋骨和髋部之间的皮肤变色(侧面),或小的红斑皮肤结节。坏死性胰腺炎是一种严重的急性胰腺炎,其特点是胰腺内和周围坏死。
慢性胰腺炎常常继发于急性胰腺炎。如果胰腺在急性胰腺炎发作时出现疤痕,它就不能恢复正常状态。腺体的损伤还在继续,随着时间的推移而导致慢性胰腺炎。大量饮酒对胰腺的损害可能在许多年内不会引起症状,但随后可能突然出现严重的胰腺炎症状。在大约20%到30%的病例中,慢性胰腺炎的病因尚不清楚。
由于急性胰腺炎是一种自限性疾病,而胰腺组织损伤仅发生在重症急性胰腺炎之后。重症胰腺炎会伴随着严重的并发症,常常威胁到生命,欧美发达国家的死亡率为10%-20%[2],因此对重症急性胰腺炎的治疗尤为重要。
MSC治疗重症急性胰腺炎
建立重症急性胰腺炎动物模型的药物:牛磺胆酸钠、雨蛙素、L-精氨酸、脱氧-STC。
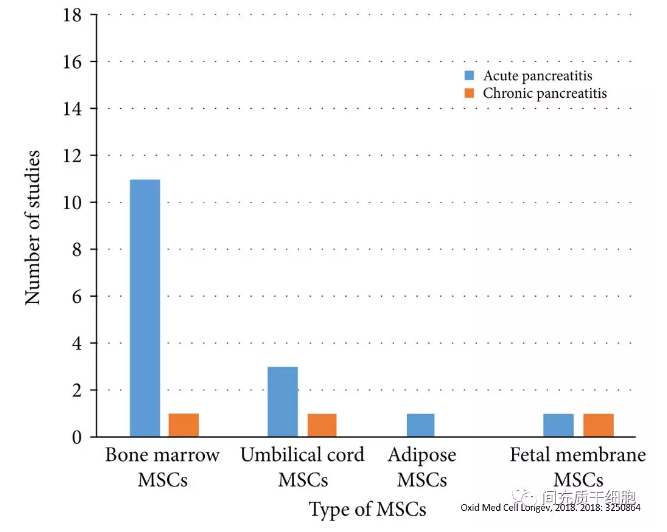
目前MSCs治疗急性胰腺炎的动物实验文章,所用MSCs的来源有骨髓、脂肪、脐带、羊膜(见下图)[3]。
动物实验的结果证明:重度急性胰腺炎组的淀粉酶和脂肪酶水平显著升高,而MSCs治疗后,淀粉酶和脂肪酶水平下降明显[4-7]。
给动物注射不同浓度的脐带MSCs:1×107个/kg、5×106个/kg、5×105个/kg、5×104个/kg;结果观察到所有的MSCs治疗组的大鼠血清淀粉酶、腹水、病理损伤、肿瘤坏死因子-ɑ和干扰素-γ均显著低于未用药对照组(P<0.05);5×104个/kg的脐带MSCs剂量组已经足够明显改善病情和症状,而且越早治疗效果越好[8]。
MSCs治疗重症急性胰腺炎的作用机制在于减轻受损胰腺的炎症、免疫调节、血管生成、减少细胞凋亡以及抗氧化作用。
01、减轻炎症
MSCs能下调重症胰腺炎动物的促炎标记物NF-κB p65、IL-1β、IL-6、TNF-α、TGF-β、NOS2、COX2、SPHK1、IL-15、IL-17的表达[4, 9, 10],还能增加了抗炎细胞因子如IL-10的表达[5, 11]。
输注MSCs后,血清MCP-1水平显著降低,MCP-1是胰腺炎发病过程中重要的趋化因子[7]。microRNA-9修饰的骨髓MSCs(pri-miR-9-BM-MSCs)同样可降低局部及血清促炎反应(肿瘤坏死因子-α、IL-1β、IL-6、HMGB1、MPO、CD68),同时增加抗炎细胞因子IL-10,促进受损胰腺的再生[12]。
02、免疫调节
CD4+T细胞耗竭可减轻胰腺炎的严重程度,因此CD4+T细胞在急性胰腺炎组织损伤的发生发展中起着重要作用[13]。犬脂肪来源的MSCs和人骨髓MSCs均可降低了受损胰腺组织中CD3+T细胞的百分率,同时增加了FoxP3+调节性T细胞(Treg)的百分率[4, 14]。然而,这项研究并没有显示MSCs输注对重症急性胰腺炎死亡率的影响。大鼠骨髓MSCs治疗也减少了CD68+细胞的数量[10]。
03、血管生成
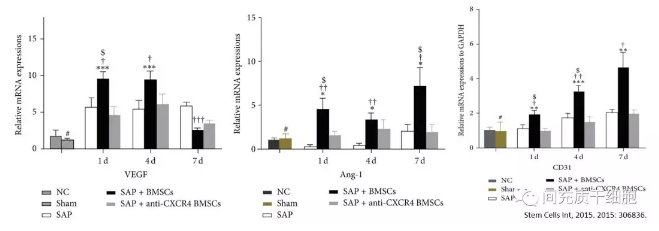
骨髓间充质干细胞经基质细胞衍生因子1α(sdf-1α)预处理后,胰腺组织中血管生成标记物(CD31、vWF、vWF)表达增加[15]。
04、减少腺泡细胞的凋亡
在一项研究中,与对照组相比,输注脐带MSCs减少了胰腺腺泡细胞的凋亡[5]。腺泡细胞坏死伴随消化酶的释放是重症急性胰腺炎发病的基本机制。总共有3项研究表明MSCs可以减轻氧化应激,这是造成腺泡细胞损伤的主要原因[16-18]。在另外两项研究中,MSCs对腺泡细胞的抗凋亡作用已被证实[4, 5]。MSCs在重症急性胰腺炎时对腺泡细胞发挥这种作用的机制,可能在于MSCs通过分泌抗凋亡趋化因子XCL1发挥抗凋亡作用[19]。
05、抗氧化
骨髓MSCs治疗重症急性胰腺炎,MSCs提高了胰腺局部组织抗氧化活性,如超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GPX)[12, 16, 17]。而且MSCs还降低了丙二醛(MDA)的水平,MDA是急性胰腺炎期间脂质过氧化的产物[16]。
联合应用自由基清除剂N-乙酰半胱氨酸(NAC)和BMSC可减轻胰腺氧化应激损伤,抑制炎症反应,明显优于单独应用BMSCs或NAC;由于NAC能提高骨髓基质细胞移植治疗SAP大鼠的疗效,综合治疗有望为严重急性胰腺炎的治疗提供一条新的途径[20]。
此外,BMSCs还能提高SAP大鼠血清和胰腺组织中HO-1的表达,HO-1继而发挥抗炎、抗氧化作用,减少细胞凋亡,促进血管生成[21]。
MSC治疗慢性胰腺炎
慢性胰腺炎的病理特点是纤维化、钙化和胰腺导管炎症[22]。存在具有独特临床和血清学特征的两种类型,I型主要以免疫球蛋白G4(IgG4)水平升高和导管周围淋巴细胞浸润、大量IgG4阳性浆细胞、层状性纤维化和闭塞性静脉炎为特征,而II型以存在粒细胞上皮病变(GEL)和缺乏IgG4阳性细胞为主要特征。后一种亚型通常与炎症性肠病共病,特别是溃疡性结肠炎,多见于儿童。
仅有3项MSCs用于治疗慢性胰腺炎的研究,MSCs静脉注射二丁基二氯化锡诱发了Sprague Dawley大鼠慢性胰腺炎[10, 23, 24]。使用MSCs后,胰腺损伤和纤维化程度降低,这一效应被认为是抑制胰腺星状细胞的结果。
注射UCMSCs可降低单核细胞趋化蛋白1(MCP1)、血管细胞粘附分子1(VCAM1)、细胞间粘附分子1(ICAM1)、白细胞介素6(IL 6)和肿瘤坏死因子α的表达[24]。用羧基荧光素琥珀酰亚胺酯(CFSE)染料追踪输注的大鼠UCMSCs,发现这些细胞定位于受损的胰腺组织,并将其植入受损的胰腺组织[24]。
在另一项研究中,核因子-κΒ(NF-κΒ)是炎症反应和凋亡的重要调节因子,然后注入IκBαM(NF-κB抑制剂)基因修饰的脐带MSCs,称为IκBαM-MSCs,用于治疗大鼠慢性胰腺炎。IκBαM-MSCs显著降低促炎细胞因子水平,增加抗炎细胞因子IL-10水平,促进胰腺星状细胞凋亡[23]。
讨论
与对照组相比,MSCs治疗组的胰腺组织损伤、坏死、炎症和水肿均有所减轻,血清淀粉酶和脂肪酶水平均降低。
除了发病率外,死亡率也是评价重症急性胰腺炎新疗法的一个重要参数。由于器官衰竭和组织坏死的并发症,死亡率是急性胰腺炎的常见后遗症(可能高达30-47%)[25]。大多数实验研究没有评估MSCs输注后的模型动物死亡率。
由于重症急性胰腺炎发病后的24小时对预后至关重要,因此应在这一时间范围内评估注射MSCs的治疗效果。MSCs治疗的研究表明,最大治疗效果的时间框架是一个重要的决定因素,早期干预几乎总是必要的[26]。
在诱导重症急性胰腺炎后,人骨髓MSCs注射后能迁移定位到受损的胰腺组织[4, 9, 12]。有趣的是,在用于重症急性胰腺炎的动物模型中,没有一项使用骨髓MSC治疗重症急性胰腺炎的研究报告了移植骨髓MSCs对死亡率的影响。而在三项使用脐带MSCs治疗重症急性胰腺炎的研究中,只有一项报告了使用脐带MSCs后的死亡率,并表明注射脐带MSCs降低了重症急性胰腺炎诱导后的死亡率[8]。
我国学者也比较了健康人骨髓MSCs和慢性胰腺炎患者骨髓MSCs的细胞功能特性;与健康人骨髓MSCs相比,慢性胰腺炎患者骨髓MSCs的生长分化因子6和肝细胞生长因子表达显著下调,而转化生长因子β和基质金属蛋白酶-2的表达显著上调;干扰素-γ诱导的吲哚胺2,3-双加氧酶在慢性胰腺炎患者骨髓MSCs中的表达高于健康骨髓MSCs;总体上,细胞表型、集落形成能力、多向分化能力、增殖、衰老、分泌特性和免疫抑制功能等方面差异不大[27]。
急性胰腺炎虽然是一种自限性疾病,能自己愈合;但是,如果不及时妥当治疗和注意饮食,即使疼痛感消失,急性胰腺炎也会转变为慢性胰腺炎。慢性胰腺炎常常伴随着胰腺纤维化,消化液分泌量减少,甚至产生胰岛素的胰岛细胞受到破坏,导致长期的饱食后腹痛、消化不良和糖尿病。因此,非常需要重视急性和慢性胰腺炎的治疗。


