什么是系统性硬化症?
系统性硬化症(SS,也称为硬皮病)是一种多系统结缔组织疾病,由于几乎所有患者都检测到自身抗体的存在而被归类为自身免疫性疾病[1,2]。硬皮病是一种风湿性疾病(即多种亚型),具有不同的临床表现和不同的病程。其特征性临床表现包括皮肤纤维化,雷诺氏现象,血管疾病,关节疼痛,指尖溃疡和毛细血管。血管舒张。胃肠道,肺部,心脏和肾功能不全等内脏器官的变化发生在皮肤改变之前或之中[1]。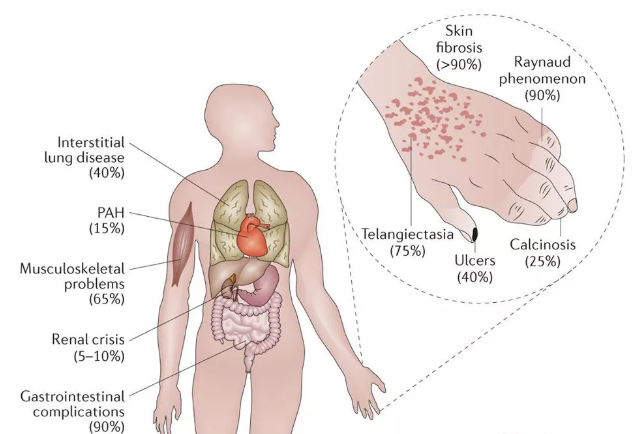
然而,全世界硬皮病的发病率估计为每年每百万人2.3-22.8例[1]。根据70亿人口,世界上的患者人数也很多。在俄克拉荷马州的Choctaw印第安人中,硬皮病的患病率最高,估计为660例/百万,这表明遗传因素和对某些种族背景的易感性可能是硬皮病的原因。在行动[3]。女性的易感性高于男性,比例在3:1和14:1之间[1]。
硬皮病的5年和10年生存率分别为68%和50%[4]。 2017年的一项研究表明,新诊断的硬皮病患者的年龄和性别调整标准化死亡率为4.06,女性和男性分别损失22.4和26。0年[5]。肺纤维化,肺动脉高压,心脏病和肾脏危象是硬皮病患者死亡的主要原因[6,7]。
2013年,美国风湿病学会(ACR) - 欧洲风湿病预防协会(EULAR)为硬皮病开发了新的分类标准和评分,包括近端硬皮病,硬趾,手指窝和肺纤维化。 ,雷诺现象和硬皮病特异性自身抗体[8](见下图)。
硬皮病的发病机制
硬皮病的主要特征是血管损伤,异常炎症反应和组织纤维化[9]。纤维化逐渐取代健康组织并最终破坏受影响区域的结构,导致衰弱症状。在纤维化组织中,正常结构被富含胶原蛋白,大部分无细胞,僵硬的结缔组织所取代,导致功能完整性丧失,导致严重功能障碍,并且在某些情况下,导致包括心脏在内的重要内脏器官衰竭和肺 - 硬皮病的致命并发症[10]。活化的炎性细胞分泌细胞因子,将成纤维细胞分化为肌成纤维细胞,产生过多的胶原蛋白,收缩并引起结缔组织的病理变化。自身免疫和基质炎症可以激活基质中的成纤维细胞并导致病理性纤维化[10]。此外,基因突变或环境触发形式的初始事件可诱导自身免疫和自身抗体产生,从而诱导先天免疫细胞(例如常驻巨噬细胞)和分泌。先天性免疫细胞因子,导致慢性炎症[10]。干细胞治疗系统性硬化症,安全有效
造血干细胞疗法
慢性炎症和自身免疫是与硬皮病相关的主要致病事件,因此逻辑上治疗任何这些过程可能是有用的。虽然目前的治疗方法包括一般免疫抑制和并发症的特异性治疗,但自体造血干细胞(HSCs)移植的免疫调节方案已被评估为系统性硬化症的新治疗策略(见下表)[11,12]。
造血干细胞治疗的基本原则是进入造血干细胞以重建免疫系统,并在免疫细胞(包括自身反应性T细胞和B细胞)大量消耗后建立免疫耐受[11]。造血干细胞在自身免疫性风湿性疾病中的临床治疗效果是重建患者的免疫系统,减少免疫细胞的异常激活,引起组织攻击,从而减缓或消除自身免疫性风湿性疾病[13]。在35例接受异基因造血干细胞移植治疗自身免疫性疾病的患者中,50%的患者经历了缓解[14]。由于系统性硬化和自身免疫性风湿性疾病之间的高度临床重叠,这进一步增加了证据并支持用于系统性硬化的造血干细胞的治疗。
迄今为止,一些自体造血干细胞移植研究已证明在国际多中心临床试验中有效,表明临床疗效持续改善,特别是治疗晚期疾病传播性皮肤硬化症[15-17]。新英格兰医学杂志2018年发表的一项新的2期临床研究表明,自体造血干细胞治疗可能是预后不良的硬皮病患者的有效治疗策略[12]。自体造血干细胞治疗为患者提供了“重启”免疫系统的机会,是目前唯一可以导致持续临床改善和长期无药物缓解的治疗方法。
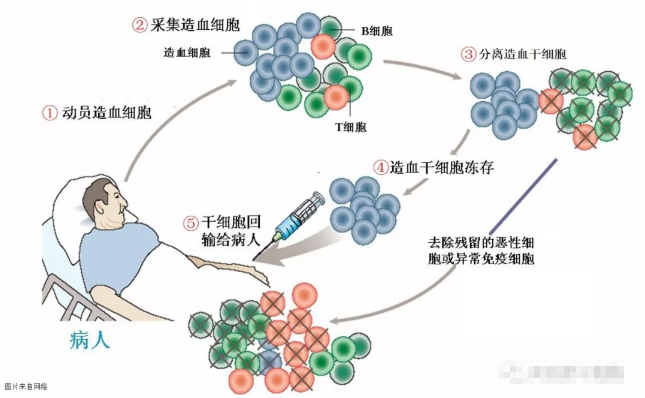
自体造血干细胞的过程如下,基本上分为五个步骤:动员,收集,分离,冷冻保存和返回。就整个过程而言,将一组造血干细胞从骨髓移动到外周循环的血液中,然后抽取血液,将造血干细胞分离并冷冻适当的时间,然后返回身体。事实上,它非常简单,即一组细胞与患者分离并返回患者体内。
间充质干细胞疗法
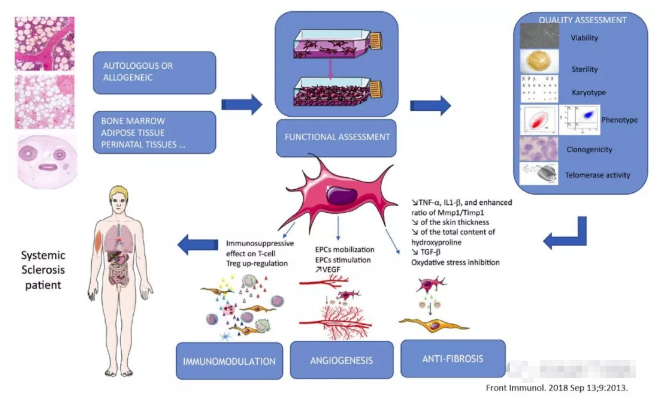
间充质干细胞(MSCs)具有促进血管生成,抗炎,抗纤维化和免疫调节的功能特性,是治疗自身免疫性疾病的理想细胞。 MSCs的功能在硬皮病的发病机制中起作用。MSCs超过10年的临床研究表明,MSCs是安全的,不会产生不良副作用,特别是在毒性,感染,死亡和致肿瘤方面[18-20]。
1. MSCs和免疫系统
硬皮病是一种自身免疫性疾病,具有改变的细胞免疫功能,包括T,B淋巴细胞功能障碍[21]和树突状细胞功能障碍[22]。尽管在疾病进展期间Tregs的数量增加,但其抑制CD4效应T细胞的能力受损[23]。 MSCs具有很强的免疫调节作用,可抑制各种免疫细胞[24,25]。 MSCs通过分泌单核细胞趋化蛋白-1(MCP-1)募集T细胞用于FasL介导的细胞凋亡[26]。 MSCs还可以通过选择性阻断免疫细胞迁移和下调趋化因子和趋化因子受体来缓解皮肤皮肤移植物抗宿主病(GVHD)模型[27]。2. MSCs和血管系统
硬皮病的血管疾病与内皮细胞(EC)功能障碍有关,其干扰细胞存活(激活和凋亡),血管生成和血管生成,并通过它们与各种其他细胞的相互作用起作用[28,29]。在血管生成期间,内皮祖细胞从骨髓移动到新血管形成的位点并分化成成熟的内皮细胞。MSCs在调节血管生成方面发挥重要作用,如后肢缺血[30,31]。 MSCs能够产生细胞因子和生长因子,保护内皮细胞免于凋亡并促进血管生成[32,33]。骨髓来源的MSCs(SSC-MSCs)来自早期,严重和快速进展的弥漫性硬皮病患者,与健康供体骨髓MSCs相比,过度表达生物活性介质和血管生成生长因子; SSC-MSCs条件培养基对体外培养的真皮微血管内皮细胞具有很强的促血管生成作用。与健康的MSC供体相比,差异有统计学意义(P <0.05)[34]。
在由硬皮病引起的严重肢体缺血的患者中,使用自体扩增后静脉输注骨髓MSC。血管造影显示MSCs促进患者四肢血运重建;组织学皮肤分析显示细胞簇是管状的。血管生成因子表达增加和血管网络恢复[34]。
3,MSC和纤维化
导致组织缺氧的微血管损伤在硬皮病及其纤维化的发病机理中起关键作用。纤维化可被认为是SSC的一个主要特征,不仅影响皮肤,还影响所有内部器官[35]。大量可溶性旁分泌介质参与纤维化,特别是转化生长因子-β信号通路,这增强了脓肿的病理过程[36]。活化的成纤维细胞是SSC的关键效应细胞。已显示MSCs对不同器官的纤维化具有治疗作用,例如肺[37-40],肾[41],肝[42,43],心脏[44]和皮肤[45]。与骨髓MSCs相比,脂肪MSCs对皮肤纤维化具有更强的抑制作用,其机制可抑制肿瘤坏死因子-β,IL-1-TIMP-1和增加MMP1 / TIMP1的比例相关(P <0.05),表明脂肪MSCs比骨髓MSCs具有更强的抗纤维化作用[46]。在博莱霉素诱导的小鼠硬皮病模型中,皮下注射ADSCs显着减少博莱霉素诱导的皮肤纤维化,减少皮肤厚度和总羟脯氨酸含量[47]。
虽然一些研究发现硬皮病患者的MSCs在体外具有与健康供体相似的免疫调节特性[48,49],但也有报道称硬皮病患者的MSCs受到增殖,分化,细胞因子分泌和免疫调节能力的影响。 。伤害[50]。因此,对自体骨髓MSC患者的治疗似乎不如健康个体中的MSCs有效。最近使用健康同种异体MSCs治疗硬皮病的临床试验表明,这可能是一种很有前景的选择[51-53]。
脐带间充质干细胞(UC-MSCs)结合血浆置换疗法,抗Scl70自身抗体滴度,血清转化生长因子-β和血管内皮生长因子水平均显着降低,硬皮病患者,肺部影像学改善,改良Rodnan皮肤评分下降从20.1±3.1到13.8±10.2 [51](见下图)。
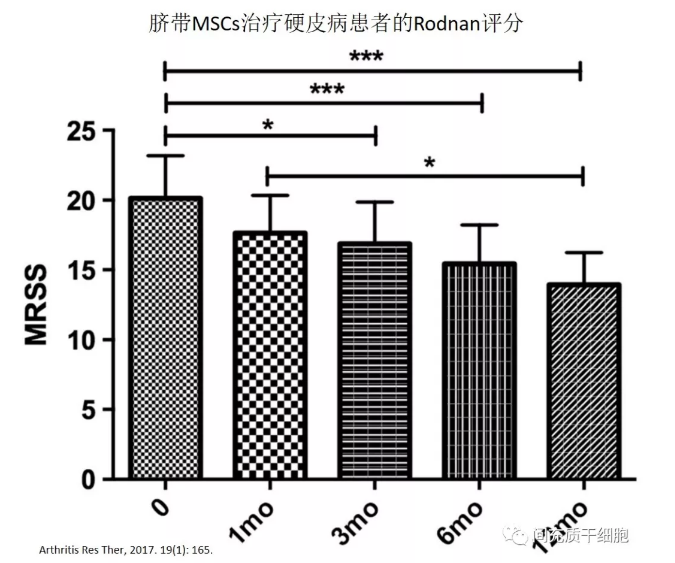
硬皮病患者和健康人MSCs的谁更安全,更有效
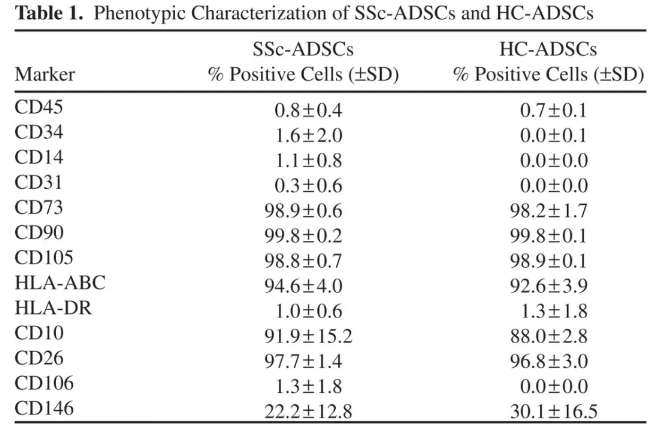
MODFR-2,CXCR4和VEGFR-2 / CXCR4细胞在硬皮病患者骨髓MSCs中的表达低于正常骨髓MSCs,且MSCs早衰[54]。利用骨髓间充质干细胞和健康人内皮细胞共培养体系,观察到健康患者的硬皮病患者骨髓间充质干细胞和骨髓间充质干细胞可以促进血管内皮细胞在应激状态下的形成,但骨髓间充质干细胞可以促进血管内皮细胞的形成。患者增殖率下降[55]。硬皮病患者的脂肪MSCs与健康的MSCs具有相同的细胞表型(见下图);与健康受试者相比,PBMC增殖抑制试验与MSCs /内皮细胞共培养之间没有显着差异。此外,在缺氧条件下,这种效应在所有共培养细胞中都得到增强[56]。然而,另一项研究将硬皮病患者的脂肪MSCs与健康个体的年龄和性别相匹配的对照进行了比较,发现硬皮病患者脂肪MSCs的增殖和迁移能力降低[57]。
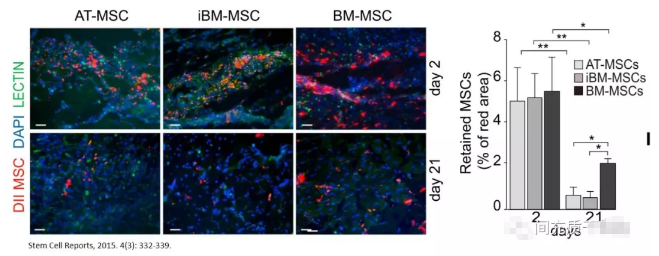
在严重肢体缺血的临床前模型中,小鼠骨髓MSCs比小鼠脂肪MSCs具有更好的治疗潜力;两种细胞类型都可以减少坏死和炎症并刺激肌肉再生,但由于MSCs位于损伤部位,保留时间会发生变化,导致MSCs强度不同[58](见下图)。在由HOCl诱导的弥漫性硬皮病的小鼠模型中,发现脂肪MSC减少。皮肤纤维化程度低于骨髓间充质干细胞[46]。
此外,长期暴露于环境损害和压力可能对MSCs的生理和生物学特性产生负面影响,如增殖,克隆,分化,免疫调节,旁分泌,长寿和衰老[59,60]。
虽然许多问题仍未得到解答,但越来越明显的是,基于MSCs的治疗应该是治疗硬皮病的一种安全且可能有效的治疗选择[11]。



