MSCs通过上调颗粒细胞AMH激素和FSH受体的表达,抑制颗粒细胞凋亡和卵泡闭锁,促进卵巢功能的恢复。临床MSCs的产生需要大量的细胞,但高代MSCs体外扩增可能导致细胞转化。根据病情轻重,确定最佳剂量和给药时间。
目前,来自骨髓、脂肪组织、脐带、脐带血、胎盘、羊水、子宫内膜、脐带沃顿胶和经血等来源的MSCs已在实验中取得成功。

以下为原件:
间充质干细胞在卵巢功能恢复中的作用
随着再生医学的发展,间充质干细胞(mesenchymal stem cells,MSCs)作为一种恢复卵巢功能的方法越来越受到重视。从骨髓、脂肪、脐血、经血和羊水中提取的MSCs可以改善卵巢功能。鉴于以往的研究和这方面的进展,利用MSCs恢复卵巢功能的期望越来越高。本文综述近年来MSCs在不孕症或原发性卵巢功能不全中的潜在应用,包括抗肿瘤治疗的现状。
间充质干细胞的特性
间充质干细胞(Mesenchymal stem cells,MSCs)是一种来源于人和哺乳动物骨髓和骨膜的细胞,在体外培养过程中可以被分离和扩增,同时保持诱导多种中胚层表型和组织的能力。简称MSC可理解为间充质干细胞、多能干细胞、间充质祖细胞、骨髓基质细胞、骨髓间充质干细胞、间充质前体细胞、骨髓干细胞和多能干细胞
为了改进这个术语的定义,国际细胞治疗学会(ISCT)将间充质干细胞定义为多潜能间充质基质细胞。建议保留“间充质干细胞”一词,指具有可塑性粘附特性的间质组织细胞,指具有干细胞两个基本特性(自我更新和向下分化多个谱系的能力)的亚群[5]。
ISCT对MSCs的定义提出了三个标准。首先,MSCs在标准培养条件下必须是可塑的。其次,95%以上的MSCs必须表达CD105、CD73和CD90,但缺乏CD45、CD34、CD14或CD11b、CD79a或CD19和人类白细胞抗原(HLA)Ⅱ类表达。第三,这些细胞必须能够在体外标准分化条件下分化为成骨细胞、脂肪细胞和软骨母细胞[5]。
间充质干细胞来源于成人或婴儿的多种组织,包括脂肪组织、外周血、脐带血、脐带血、脐带、脐带膜、脐带静脉、沃顿脐带冻、胎盘、基膜蜕膜、粗韧带、羊水、羊膜、牙髓、人胎盘绒毛、胎膜,经血、母乳和尿液[6]。
MSCs具有较强的调节免疫应答的能力,包括抑制T细胞增殖、影响树突状细胞成熟和功能、抑制B细胞增殖和终末分化、调节其他免疫细胞,如自然杀伤细胞和巨噬细胞等[7]。MSCs在细胞治疗中的另一个作用是归巢和跨内皮细胞迁移。在循环中,MSCs通过趋化因子(c-cc motif)、粘附分子(P-选择素和VCAM-1)、基质金属蛋白酶(MMPs;MMP-2和膜型1 MMP)通过血管系统转运到损伤部位[8]。骨髓间充质干细胞修复受损的组织部位后,与局部刺激密切相关,如恶臭细胞因子、Toll样受体配体和低氧,这可刺激MSCs产生大量的生长因子以促进组织再生的多种功能[8 ]。基于MSCs的这些功能,Caplan建议将MSC的缩写理解为“医疗信号细胞”
卵巢功能与卵巢早衰
卵泡是卵巢的功能单位,由卵母细胞及其支持细胞如颗粒细胞、卵泡膜细胞和基质细胞组成。卵泡中的细胞每月释放一个卵母细胞,产生生育能力和雌二醇、孕酮等激素,以维持妇女的整体健康和维持妊娠[10]。
卵巢早衰(POF)是一种神秘而复杂的疾病。POF的患病率为35岁以下妇女的250分之一和40岁以下妇女的100分之一。POF最重要的机制是滤泡功能障碍和滤泡衰竭[11]。
虽然POF的病因尚未完全阐明,但遗传、内分泌、旁分泌、线粒体功能障碍和代谢因素可影响卵泡池和卵母细胞的质量[12]。
近年来,化疗引起的POF已成为抗癌治疗的主要长期不良反应,增加了不孕和退行性健康问题的风险。这种对化疗的反应可能是年轻女性的一个特殊问题,因为卵巢储备的丧失与女性不孕的风险密切相关。抗癌药物的卵巢毒性的确切机制尚未完全建立(13),这似乎取决于药物的类型和所测试的细胞类型[14 ]。基质细胞和颗粒细胞通过凋亡受到大多数抗癌药物的强烈影响。已知卵母细胞通过包围它们的基质和颗粒细胞受到间接毒性的影响。
环磷酰胺(CTX)是一种烷基化剂,能诱导活性增殖细胞(如颗粒细胞和基质细胞)DNA双链断裂,卵母细胞也会受到CTX等抗癌药物的损伤[13]。
然而,另一个有趣的解释是,原始卵泡不增殖,因此对DNA损伤不太敏感。静息或激活状态下的原始卵泡受细胞内磷脂酰肌醇3激酶(PI3K)-Akt-mTOR信号通路控制[15]。磷酸酶和张力素同系物(PTEN)是PI3K的可逆抑制剂,被称为人类肿瘤抑制因子[16]。
抗癌药物如CTX或顺铂被发现通过过度分泌导致原始卵泡功能衰竭[17],卵母细胞特异性PTEN的缺失导致小鼠模型中原始卵泡池的过早激活[18]。
因此,维持生育能力和卵巢功能应被视为育龄妇女接受化疗的重要问题。保存生育能力的几种选择,如胚胎、成熟卵母细胞或卵巢组织的冷冻保存。然而,大多数项目在癌症治疗前保留生育能力。因此,有必要探讨恢复卵巢功能的可能途径。
MSc治疗与卵巢功能恢复
MSc治疗被认为是治疗女性不孕症或恢复卵巢功能的新选择。
许多研究证实了不同来源的MSCs对POF动物模型卵巢功能的保护作用(表1)[19-48]。这里的这些
与其他形式的细胞治疗一样,间充质干细胞恢复卵巢功能的两种不同给药方法也被考虑。尾静脉注射已被引入小鼠和大鼠模型,局部卵巢注射技术也得到了广泛的发展[50]。在抗癌药物化疗引起的卵巢功能衰竭中,MSCs移植可诱导卵巢功能的恢复,包括雌二醇的产生和卵巢结构的改善[30,33]。
MSCs对CTX或顺铂等抗癌药物诱导的基质细胞或颗粒细胞凋亡具有保护作用(表1)。MSCs产生的一些细胞因子,包括VEGF、HGF和IGF-1,可能在体内抑制颗粒细胞凋亡,上调B细胞淋巴瘤-2的表达[51]。
MSCs的另一个预期机制是其抗纤维化作用。卵巢纤维化与多种细胞因子有关,包括基质金属蛋白酶、基质金属蛋白酶组织抑制剂、转化生长因子-1、血管内皮生长因子和内皮素-1。MSCs可以抑制FB细胞的增殖,减少细胞外基质的沉积[51]。
血管生成是卵巢恢复的重要机制。血管内皮生长因子-2,特别是来自MSCs的血管生成素,诱导新生血管形成,促进受损卵巢组织的血液灌注[44,51]。人胎盘间充质干细胞移植后,通过调节T细胞及相关细胞因子恢复POF小鼠卵巢功能[29]。人羊膜间充质干细胞移植到自然衰老小鼠体内12-14个月后,移植的间充质干细胞通过分泌表皮生长因子和HGF在抑制卵巢衰老中发挥重要作用[22]。然而,MSC移植促进卵巢功能的机制尚需进一步研究。
表1:MSc支持的卵巢功能研究
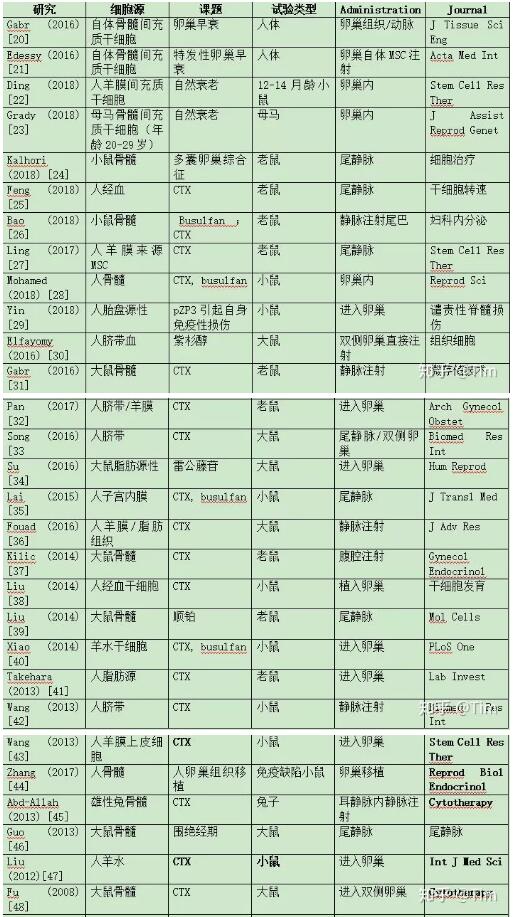
间充质干细胞;环磷酰胺
一种新的卵巢功能恢复候选MSCs
临床应用需要多剂量间充质干细胞,剂量范围为每公斤体重100-500万个细胞[52],在动物实验中,每只小鼠或大鼠的细胞数为100-50万个单位。然而,从成人组织中获得MSCs需要合适的供体,而且在大多数情况下,需要进行有创手术。此外,长期培养可能会增加诱发染色体畸变和异质细胞群的风险,使协议难以标准化[52]。
人胚胎干细胞(hESCs)来源于囊胚的内部细胞团,具有多种分化潜能。一些研究表明,MSCs可以从hESCs中获得,hESCs表达MSC的表面标记,并分化为三个胚胎层(如软骨细胞、成骨细胞和脂肪细胞)[53]。此外,据报道,这些细胞在体外实验中发挥免疫调节作用[54]。HESC来源的MSCs相当于骨髓或脂肪来源的MSCs,使其成为恢复卵巢功能的MSCs的替代来源[52]。然而,与人类胚胎的使用有关的伦理问题仍然存在,并且关于移植过程中HESCs不受欢迎的、意外的或未控制的差异的担忧仍在讨论中。然而,基于hESCs和hESC衍生MSCs的各种疾病的临床试验已经开始[55]。诱导多能干细胞(IPSC)可能是MSCs的另一来源。IPSCs可以通过微创手术获得,避免了胚胎使用和hESCs的伦理问题。此外,使用autos或HLA匹配的iPSCs可以最大限度地减少免疫问题[56,57]。
MSCs的另一个候选者是外体,外体是由细胞分泌的膜生物纳米粒。它们在系统中循环,携带mRNA、长的非编码RNA、microRNA、蛋白质和脂质。在肿瘤生理学中,细胞增殖、凋亡、细胞因子产生、免疫调节和转移等过程中都存在细胞外体的刺激或抑制作用[58]。MSC介导的细胞治疗中的外体在许多疾病模型中被发现,并被发现促进功能恢复[59]。人脂肪或脐血来源的MSCs改善了卵巢早衰小鼠模型的卵巢功能[60,61]。但是,在外显子的分离、表征和管理方面还存在一些标准化问题[59,62]。
MSCs的安全问题
间充质干细胞的安全性应该得到重视,因为给药后观察到轻微的不良反应。最严重的副作用是长期培养的MSCs促进了肿瘤的生长和转移。临床MSCs的产生需要大量的细胞,需要体外扩增,但高代MSCs可能导致细胞转化。根据病情的严重程度,确定最佳给药剂量和给药时间。有必要了解间充质干细胞的调控机制,制定相应的管理方法。
结论
MSCs已成为细胞治疗临床应用中最有效的细胞类型。多发性退行性疾病和一些免疫相关疾病已被报道对MSC移植有反应。骨髓、脂肪组织、脐带、脐血、胎盘、羊水、子宫内膜、脐带沃顿胶和经血的MSCs是成功的实验对象。
据报道,MSCs通过上调颗粒细胞AMH激素和FSH受体的表达,抑制颗粒细胞凋亡和卵泡闭锁,促进卵巢功能的恢复目前,对骨髓间充质干细胞的再生和利用以恢复卵巢功能的研究,可以给POF患者和不孕或亚生育妇女带来希望。


