卵母细胞和胚胎的线粒体功能受年龄和氧化应激的干扰
据美国疾病监控中心(Centers for Disease Control)监测,美国的临床辅助生殖技术(ART)成功率显示,每八对北美夫妇中就有一对寻求治疗以治疗不育症,这通常需要ART。但是,在过去的20年中,抗逆转录病毒治疗后的活产率在每个周期中没有超过30%的改善。胚胎质量仍然是预测抗逆转录病毒疗法成功率的重要决定因素(67)。人植入前胚胎死亡率的数学模型表明,可能导致合子发育的因素可能是在合子阶段之前确定的(68,69)。已经提出,胚胎在体外通过从母体控制向合子控制过渡的能力主要取决于已经存在于原始卵母细胞中或在卵泡生长过程中获得的细胞质组分。随着周期中期LH激增的开始,卵丘细胞和卵母细胞之间的间隙连接被破坏,卵母细胞的细胞质含量被固定,而新形成的合子基因组的影响最小(70)。因此,排卵后,成熟卵母细胞和随后的胚胎的存活几乎完全取决于在卵母细胞生长和成熟过程中积累的母体mRNA,蛋白质和其他因素,尤其是线粒体(71),这些成分似乎是那些停滞的胚胎缺乏或功能异常。
|| 注释:线粒体(mitochondrion)是一种存在于大多数细胞中的由两层膜包被的细胞器,是细胞中制造能量的结构,是细胞进行有氧呼吸的主要场所,被称为"power house"。除了为细胞供能外,线粒体还参与诸如细胞分化、细胞信息传递和细胞凋亡等过程,并拥有调控细胞生长和细胞周期的能力。
线粒体与能源生产
线粒体被认为是原核祖先,后来成为真核生物的共生体(72)。线粒体基因组(mtDNA)是双链环状DNA,与核DNA不同,它不包含组蛋白,不包含内含子,不包含任何DNA修复酶,因此对突变高度敏感( 73)。MtDNA编码涉及三磷酸腺苷(ATP)产生的呼吸链复合物的13种蛋白质的37个基因(74),22个转移RNA基因和2个核糖体RNA基因。可能发生了许多线粒体基因向核基因组的转移,使易受害的DNA的一部分远离了附近的能量产生位点,从而产生了大量的活性氧(ROS)(75)。线粒体的遗传严格来说是母体。受精后,通过同种异体(非自身)细胞器自噬进行的溶酶体降解,卵母细胞消除了父系线粒体(76)。卵母细胞中的线粒体形态也很独特,具有非典型的圆形形状,线粒体膜厚和很少的cr裂,并且卵母细胞的线粒体通常具有单个mtDNA基因组和空间调节的呼吸活动(77)。
线粒体生理学的一个重要特征是线粒体数量的增加,因为人类卵母细胞从原始状态开始发展,当卵母细胞含有大约6,000个线粒体时,到成熟的中期II(MII)卵中将包含300,000至400,000或更多的线粒体(78)。卵母细胞成熟过程中线粒体数目的巨大扩展的推测是卵母细胞正在积极地为受精和与早期胚胎发育相关的分裂分裂的能量需求增加做准备。这似乎是合理的,因为MII卵中不存在线粒体DNA复制的能力,直到胚泡期才在胚胎中重新激活(79)。因此,随着胚胎从1个细胞的合子扩展到包含60-100个或更多细胞的胚泡,每个细胞的线粒体数目将不断被稀释。通过评估在胚胎植入前胚胎发生期间与卵母细胞相比,卵裂球中线粒体DNA含量降低,以及在胚泡期胚胎中每个细胞的线粒体数量减少,可以支持这种假设(81)。
有证据表明,老年不育患者的卵母细胞线粒体活性异常且ATP的生成减少,从而限制了胚胎的正常发育。有人提出,线粒体库的insufficient赋不足会导致胚胎发育不佳(82),线粒体的补充至少在实验室和家养物种中可以提高受精率(83、84)。许多研究提出卵母细胞中ATP利用率不足与减数分裂纺锤体异常(导致染色体分离缺陷)之间存在联系(85、86)。不良的纺锤体形成将导致由这些ATP受损的卵囊产生的合子无法形成有活力的胚泡(87、88)。小鼠体内的研究表明,卵母细胞中线粒体氧化磷酸化的破坏会导致减数分裂纺锤体异常并降低植入前胚胎的发育潜能,这一观点得到了支持(89)。
卵母细胞,实际上是产生GC和卵丘细胞(CC)的粒前性细胞在体内是独特的,因为妊娠后期没有细胞分裂。因此,在老年妇女中,原始卵泡中的卵母细胞和GCs会暴露于线粒体呼吸作用数十年来产生的低水平的ROS,从而导致线粒体和mtDNA的累积损伤。线粒体的功能状态有助于卵母细胞的质量(82)。通过形态学评估,较高质量的卵母细胞含有较高的ATP水平,受精后更可能进入胚泡期(88)。在预后阶段,不适当的线粒体活性与早期发育停滞和死亡有关(90)。随着女性年龄的增长,卵母细胞内的线粒体活性逐渐下降(91、92)。此外,卵母细胞中线粒体的数量与其受精和植入前发育的可能性之间存在直接的相关性(93)。此外,有IVF尝试失败史的女性经常会破坏卵母细胞内的线粒体功能(82)
卵巢衰老的鼠模型
为了确定衰老是否会影响鼠卵母细胞的线粒体功能,在一系列线粒体检测中,将12个月大的鼠卵母细胞与10周大的鼠卵母细胞进行了比较(94)。从这些研究中,可以确定线粒体在衰老的卵母细胞中不能完全发挥功能,这表现为代谢活性降低,线粒体膜电位增加和柠檬酸盐/ ATP比值降低。另外,许多调节线粒体功能的基因被下调。老年动物产生的卵母细胞具有纺锤体缺陷增加和频繁的染色体分散。重要的是,人们发现,通过孕妇补充线粒体营养辅酶Q10可以部分或完全纠正这些线粒体异常(94)。CoQ10延缓了年龄介导的卵母细胞丢失,因为与年龄相称的对照对象相比,CoQ10处理的大坝卵巢中原始,初级和早期次生卵泡的数量增加,导致排卵的oo- cytes。繁殖试验证实,暴露于辅酶Q10的大坝的繁殖性能得到改善(图1)(94)。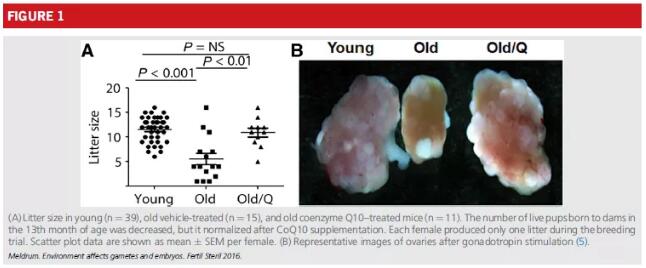
除了线粒体的变化外,还观察到年龄较大的雌性卵母细胞被较少的CC包围,这是由于细胞死亡率增加所致(94),这表明年龄较大的雌性卵母细胞可能由于代谢不足而处于代谢应激状态来自CC衍生因子的“营养”,其中之一就是辅酶Q10。有趣的是,辅酶Q10处理导致每个卵母细胞周围的CC数量增加,这表明该治疗效果并非与生殖细胞隔离。由于辅酶Q10处理提高了老年母亲的胚胎质量和育种性能,因此研究了雌雄同体CC中辅酶Q合成基因的表达。该表达调查的结果表明,老年女性的CC降低了参与CoQ10产生的几种酶的表达。在鼠类CC中,Pdss2和CoQ6 mRNA受到的影响最大(94)。
为了确定卵母细胞产生的辅酶Q减少是否可能导致生殖衰老,研究人员通过Cre-lox介导的遗传方法有条件地破坏了幼鼠卵母细胞中的Pdss2。在表型上,Pdss2的失活以及随后卵母细胞中CoQ合成的抑制作用会在3至4个月大时耗尽卵巢储备。早在2个月大时就观察到卵泡数量减少和排卵反应非常差。那些存活并排卵的卵母细胞重现了在老化的卵母细胞中观察到的许多缺陷,包括ATP产量降低和线粒体活性差(94)。这些结果证实,通过在卵母细胞中CoQ产量的单独下降,可以在年幼的动物中产生衰老表型,并且有兴趣的是,通过向动物补充CoQ10可以逆转这种现象。
CoQ10的临床用途
通过临床补充IVF的老年妇女饮食,以600 mg / d的CoQ10补充2个月来尝试转化这些发现。在对少量女性进行的随机双盲研究中,尽管通过CoQ10处理的卵母细胞非整倍性频率为46.5%,而使用CoQ10处理的女性为62.8%,但对卵母细胞极体的阵列比较基因组杂交(aCGH)并未显示出对卵母细胞非整倍性的显着影响。安慰剂治疗组(95)中的百分比。需要更大,更明确的研究来确定辅酶Q10对老年妇女的生殖结果是否有任何积极的好处。
结论
在生殖衰老或胚胎发育不良和反复妊娠失败的情况下,改善卵母细胞和胚胎中的线粒体能量产生可能会导致生殖结果的改善。补充线粒体营养素(例如CoQ10)有望在将来提高活产率。
线粒体DNA含量是整倍体胚胎的生存标志
卵母细胞和胚胎中的线粒体
众所周知,高比例的卵母细胞会导致发育不全的胚胎或即使染色体和形态正常的胚胎也无法植入。尚未充分探讨的人类胚胎生存力的一个重要方面是评估充足的能量供应(107)。在卵母细胞和早期胚胎中,线粒体的ista很少,这表明它们的氧化磷酸化能力较弱(108)。
尽管在大多数体细胞和组织中mtDNA含量和ATP合成具有很好的相关性,但种系并非如此(109)。卵母细胞线粒体含量以mtDNA拷贝数表示,其依据是卵母细胞线粒体仅包含一个或两个基因组(110)。线粒体聚集在成熟的卵母细胞中,在MII阶段从每个原始生殖细胞6,000个增加到300,000个至400,000个(78),并且在受精和植入后早期阶段之间没有进一步的复制发生(110)。因此,卵母细胞中mtDNA的总量必须在胚胎分裂过程中形成的细胞之间分配,因此,在发育的第5-6天,每60-100个细胞与原始卵母细胞相比包含的mtDNA拷贝的受精卵要少得多。
卵母细胞中积累了大量的mtDNA,并且在爆炸前没有恢复复制这一事实促成了卵母细胞中mtDNA含量与受精结果和胚胎存活率相关的概念(82、111、112)。由于mtDNA拷贝数指示卵母细胞中线粒体的数量(113),因此有人提出了MII卵母细胞允许受精后胚胎发育的mtDNA拷贝数阈值(84、110)。一些作者认为,卵母细胞的mtDNA含量与受精之间存在一定的关系(82、84、104),将未受精卵母细胞中较低的mtDNA含量与受精失败间接联系在一起,但无法辨别是结果还是原因。然而,其他人则表明这种关联是不一致的(114、115)。
线粒体和胚胎能量
尽管通常认为线粒体可以维持从早期卵裂到胚泡期的胚胎发育(116),但一些研究表明,在动物模型中并非如此。在线粒体转录因子A的基因敲除小鼠模型中,已证明卵母细胞中线粒体数目减少不会影响受精或早期胚胎发育(80)。而且,删除维持,复制和表达小鼠mtDNA的必需基因并没有显示出胚胎着床率的变化,而是导致了胚胎致死率(80)。从生物学的观点来看,如果卵母细胞和胚胎依赖于外部代谢源,那么进化将为具有营养和氧气交换能力的胚胎带来竞争优势是合理的。但是,卵母细胞和早期胚胎是具有较低表面几何形状的球体,因此交换能力较低。综合所有这些数据表明,卵母细胞中积累的线粒体可提供胚胎发育过程中所需的能量,直至达到阈值,只有在代谢燃料减少的极端情况下,细胞机制才会做出反应,尝试增加mtDNA拷贝数产生更多不起作用的线粒体。
线粒体作为能量压力传感器
胚胎取决于卵母细胞成熟过程中的能量积累。结果,在某些情况下,mtDNA拷贝数可能是结果,而不是卵细胞能量状态的根本原因。观察到线粒体功能障碍通常与严重的线粒体过度增殖有关,这证明了这一点。因此,“线粒体窘迫”的致病作用是线粒体过度生产的显着增加(117)。
线粒体的生物发生需要调节许多过程。除了mtDNA合成外,新线粒体的生物发生还需要合成和导入核编码蛋白,并组装源自双基因起源(核DNA和线粒体DNA)的蛋白。该调节涉及一组核转录因子。首先认识到的是核呼吸因子1和2,以及与雌激素相关的受体a,环状单磷酸腺苷反应元件和ying yang 1转录因子(118)。
主要的组织者是过氧化物酶体增殖物激活受体(PPAR)的共激活子家族,PPAR共激活子1a(PGC-1a)是主要成员。在PGC-1a中连接了多种调控核编码线粒体因子表达的途径,PGC-1a被认为是线粒体生物发生的主要调控者(119)。有限的能量供应会增加细胞内单磷酸腺苷(AMP)/ ATP的比例,这可通过AMP激活的蛋白激酶(AMPK)来检测。AMPK磷酸化并激活PGC-1a。AMPK的磷酸化作用还促进了PGC-1a启动子上依赖PGC-1a的诱导(120),诱导线粒体成熟并增加了mtDNA拷贝数。
线粒体DNA含量作为胚胎生存能力的标志
因此,胚胎中mtDNA拷贝数的增加是代谢应激的症状(图2)。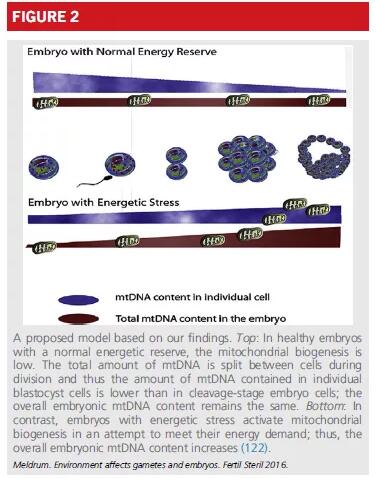
胚胎试图通过增加其mtDNA含量来平衡能量不足。精力充沛的压力可能与卵母细胞成熟过程中的内在因素有关,或者可能是由于mtDNA突变引起的呼吸能力受损所致。与这一概念一致的是,一项杰出的研究表明,m.3243A> G“线粒体肌病,脑病,乳酸性酸中毒和中风”突变导致发芽囊泡的mtDNA拷贝数逐渐增加。进入胚泡期(121)。
两个实验室(122,123)独立地证明,整倍体胚胎中高的mtDNA拷贝数指示着较低的胚胎着床能力。Diez-Juan等人的研究。根据将胚胎活力与植入潜能联系起来的mtDNA拷贝数,证明了线粒体评分(Mito- Score [Ms])的临床实用性。研究人员分析了290名整倍体胚胎的mtDNA拷贝数,这些胚胎对应于270名接受单胚移植的植入前遗传学筛查的患者。
Ms <34(MsA)的第3天胚胎的着床率(IR)为59%(n 1⁄4 51);34-52(MsB)的患者的IR为44%(n 1⁄4 52);Ms 52-97(MsC)的患者的IR为42%(n1⁄450);Ms> 97(MsD)的患者的hadanIR为25%(n1⁄4 52)。Ms> 160(n 1⁄4 22)的胚胎从未植入。Ms <18.19(MsA)的第5天胚胎的IR为81%;年龄为18.19-24.15(MsB)的患者的IR为50%(n 1⁄4 16);毫秒为24.15-50.58(MsC)的患者的IR为62%(n 1⁄4 16);Ms> 50.58(MsD)的患者的IR为18%(n 1⁄4 17);Ms> 60(n 1⁄4 7)的胚胎从未植入。
这些发现也支持旨在通过在卵母细胞成熟过程中营养补充线粒体营养物来增加胚胎能量储备的策略的开发(87、95、124)。这项工作的逻辑临床翻译是将mtDNA拷贝数分析纳入由aCGH或现在由下一代测序进行的常规遗传分析中。目前在我们实验室中正在进行一项较大的前瞻性随机试验,比较形态学分类与整倍体胚胎中的Ms作为独立的胚胎生存能力标记。
辅酶Q10应该怎么吃?
辅酶Q10补充的最佳时机,持续时间和剂量尚不清楚。在研究中,根据以往对IVF人群的研究,治疗时间是任意选择的。可以认为,辅酶Q10治疗意味着ART周期启动的延迟,因此更长的预处理时间可能不被患者接受。已经证明,CoQ10对健康成人的耐受性良好,并且每天摄入量高达900 mg 是安全的。尽管这是相当直观的选择,但我们在选择辅酶Q10的剂量方面拥有丰富的经验。
结论
总之,对于卵巢储备能力低的年轻低预后患者,用CoQ10进行预处理可增强卵巢对刺激的反应,并改善卵母细胞和胚胎质量。对临床妊娠和活产率可能有有益的影响,但这需要在较大的随机对照研究中得到证实。需要进一步的工作来确定最佳的治疗时间,时机和剂量,并评估补充CoQ10在低预后的POR其他亚组中的治疗效果。


